بخش تحقیق و توسعه کمپانی آرتوت
 مقدمه:
مقدمه:
آرتویدا (ARTEVIDA) محصول شرکت آرتوت ایالات متحده، حاوی 48 نوع ماده مغذی است و شامل مجموعه ای کامل از آمینو اسیدهای ضروری، آنزیمها، اسیدهای آلی، اسیدهای چرب ضروری، ویتامینها، مواد معدنی، پری و پروبیوتیکها است، که در ساعات ابتدایی خروج جوجه از تخم شامل زمان حمل به مزرعه و 48 ساعت اولیه ورود جوجه به مزرعه در اختیار پرنده قرار میگیرد. این محصول بعد از مخلوط شدن با آب ، تبدیل به ژل می شود و مقادیر مناسبی آب را در خود ذخیره می کند. بطور مستقیم (بویژه در طول حمل جوجه به مزرعه) یا مخلوط با جیره پری استارتر در ساعت اولیه در اختیار پرنده قرار گیرد. آرتویدا به دلیل نوع محتویات (9گونه باکتری و مخمر اختصاصی به عنوان پروبیوتیک، 5 نوع آنزیم هضم کننده NSPs و فیتاتها، دو آمینو اسید ضروری، چندین نوع اسید آلی، دکستروز، اسید لینولئیک، ویتامینهای ب- کمپلکس و محلول در چربی، ترکیبات پری بیوتیکی، لیپاز، پروتئاز و آمیلاز) و زمان عرضه به پرنده میتواند موجب فواید ذیل در صنعت مرغ گوشتی ، تخمگذار ، بوقلمون و بلدرچین می گردد.
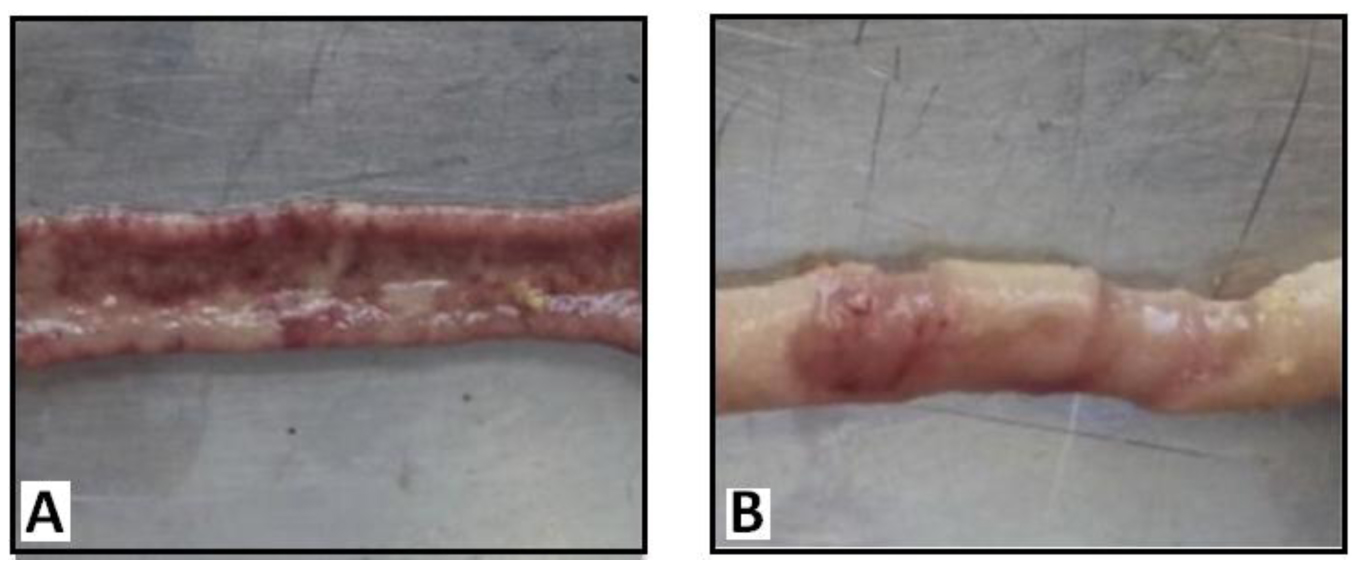
التهاب نکروتیک (NE) یا ورم روده یک عارضه چند عاملی و باکتریایی است و اولین بار توسط پرش (1961) گزارش شد که موجب خسارتهای قابل توجه در صنعت طیور و ایجاد تلفات سنگین در مزارع پرورش میگردد. تلفات ناشی از این عارضه میتواند به 30 درصد گله برسد و در سال 2000 خسارت آن حدود 2 میلیارد دلار بود و که این رقم به 5 تا 6 میلیار دلار در سال 2015 بالغ شد.
(Wade and Keyburn 2015).
عامل التهاب روده، باکتری گرم مثبت و بی هوازی کلستریدیوم پرفرینژ است که دارای اسپورهای میلهای و توانایی تولید طیف وسیعی از توکسینهای خارجی و آنزیم های تهاجمی میباشد. فاکتورهایی آسیب زننده موکوس دستگاه گوارش از قبیل افزایش ویسکوزیته محتویات، بالا بودن پروتئین خوراک و عفونتهای کوکسیدیوزی میتوانند شرایط توسعه و تشدید این عامل باکتریایی را فراهم نمایند. علائم کلینیکی التهاب روده منجر به نکروز قابل توجه روده و درصد فاجعه بار تلفات میشود، در حالی که التهاب روده در شکل تحت کلینیکی با اندک نشانههایی همراه است و در مراحل ابتدایی تنها با نشانه کاهش رشد همراه می باشد و به دلیل آسیب جذب غذا از بافت آسیب دیده موکوس روده همراه است. بنابراین بهدلیل نبود علائم واضح موجب به تاخیر افتادن اقدامات پیشگیرانه شده و بیماری تمام گله را آلوده و در نهایت موجب کاهش شدید تولید میگردد (Keerqin et al. 2017). در این مطالعه با توجه به تحقیقات مختلف در زمینه چالشها و بحرانهای پیش روی پرنده در اولین ساعات خروج از تخم و نحوه مقابله با این چالشها اثر برخی از ترکیبات موجود در آرتویدا در مدیریت این مرحله بحرانی و ارتقاء سلامت کلی پرنده و در نهایت راندمان رشد پرنده مورد بررسی قرار میگیرد.
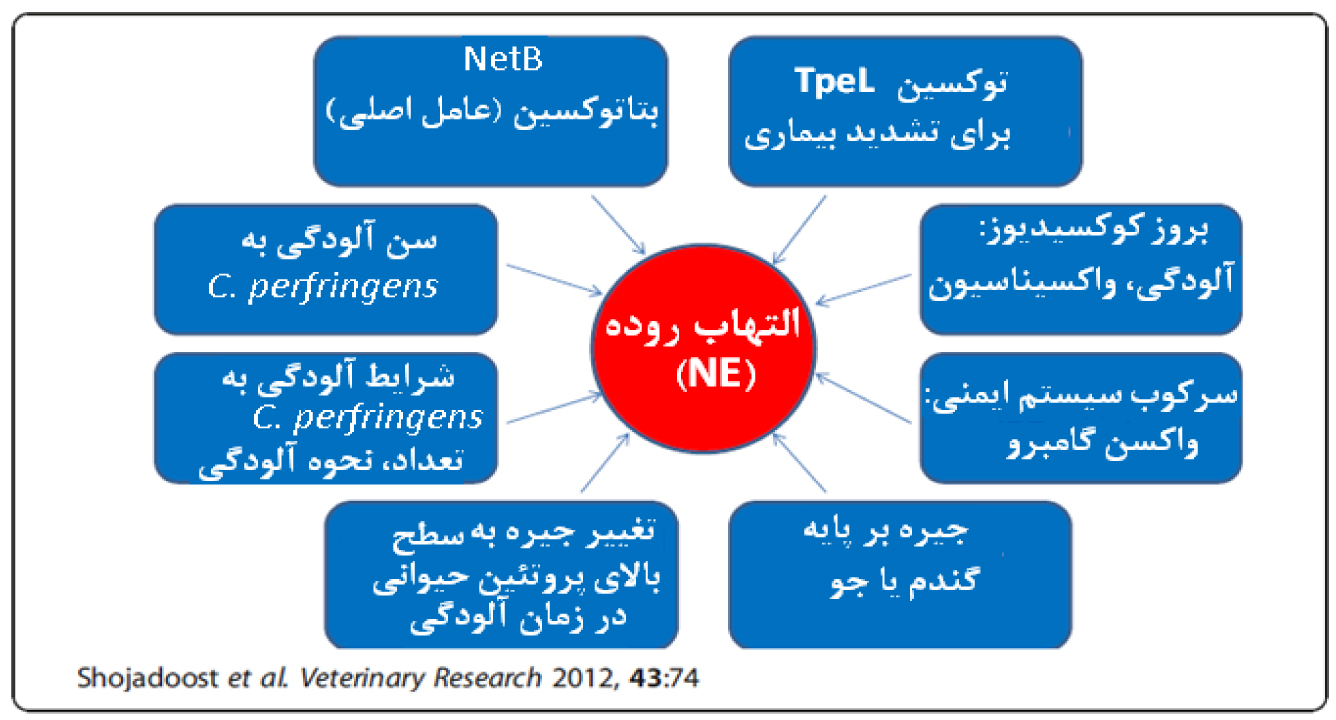
 شکل 1. مجموعه ای از عوامل اصلی و تشدید کننده NE را نشان میدهد.
شکل 1. مجموعه ای از عوامل اصلی و تشدید کننده NE را نشان میدهد.
فاکتورهای حیاتی موثر در توسعه التهاب روده و خلاصهای از عوامل مهم برای بروز التهاب روده: اصلی ترین عامل حضور netB و پلاسمید netB است، دیگر عوامل خلاصه شده در این تصویر میتوانند شدت درگیری را تحت تاثیر قرار دهند. TpeL: توکسین تولید شده بوسیله نژادهای مختلف C. perfringes در روده فعال میشود. این توکسین اخیرا کشف شده و در میان 17 نوع توکسین تولید شده بوسیله این باکتری دارای بیشترین وزن (kDa– 207) مولکولی است (and Bruce 2015 Chen). 🙁NetB =Necrotic enteritis B-like toxin) سیتوتوکسین تولید شده بوسیله C. perfringes در دستگاه گوارش طیور (Keyburn et al. 2010).
 آرتویدا و عرضه سریع مواد مغذی
آرتویدا و عرضه سریع مواد مغذی
مدت زمان خروج جوجه از تخم مرغ و دسترسی به اولین غذا نقش تعیین کننده ای در زنده مانی و راندمان پرندگان دارد. به دلیل ماهیت صنعت طیور، اغلب پرندهها تا 48 ساعت پس از هچ از آب و غذا محروم هستند. دسترسی سریع به غذا بویژه آمینو اسیدها میتواند نقش تعیین کنندهای در توسعه سیستم ایمنی ایفا نماید. مطالعات متعددی گزارش کردند که دسترسی سریع به آب و غذا بویژه به آمینواسیدها میتواند نقش موثری بر مقاومت پرنده در برابر باکتری کلستریدیوم پرفرینژ و بروز NE داشته باشد. مطالعات کرکوین و همکاران (2017) روی جوجه های گوشتی نشان داد ارائه یک ماده مغذی محتوی سطح بالای اسیدهای آمینه، موجب راندمان بالاتر (FCR پایین) در زمان چالشهای حاصل از درگیری پرنده به التهاب روده باشد.
 آرتویدا پروبیوتیکها و پری بیوتیک ها
آرتویدا پروبیوتیکها و پری بیوتیک ها
در طبیعت جوجه تازه هچ شده تمام میکرو فلورهای دستگاه گوارش مادر را از طریق تماس با فضولات دریافت و به تدریج در مقابل پاتوژنها ایمن و محافظت میشود. در شرایط تجاری بطور معمول این طیف از باکتریها بدلیل استریل بودن محیط در روده جوجهها وجود ندارد. بنابر این استفاده سریع از پروبیوتیک ها در طیور بویژه در ساعات ابتدایی حیات بسیار حائز اهمیت است و نقش تعیین کننده ای در مراحل بعدی رشد پرنده خواهد داشت(Fuller 2001).
اغلب محققین معتقد اند که در شرایط طبیعی، تعادل غیر پایداری از باکتری های مفید و غیر مفید در دستگاه گوارش وجود دارد. تا زمان بر هم نخوردن این تعادل، فعالیت های فیزیولوژیک پرنده با حدکثر راندمان انجام میشود. با بروز استرس تعادل باکتریایی برهم خورده و جمعیت باکتریهای مفید بویژه لاکتوباسیل ها کاهش مییابند. برخی عوامل محیطی و تغذیهای میتوانند موجب بر هم خورد این تعادل گردند. شرایط بهداشتی، درمان آنتی بیوتیکی و استرس، اصلی ترین عوامل در این ارتباط میباشند. تنظیم جیره با سطح بالای گندم و پروتئینهای حیوانی میتواند منجر به بالا رفتن pH دستگاه گوارش گردد (William et al. 2003). پروبیوتیکها میکروارگانیزمهای زنده و غیر بیماریزا هستند که با استقرار در دستگاه گوارش و تغییر در تعادل جمعیت میکروبی محیط میتوانند موجب افزایش سطح سلامت دستگاه گوارش گردند. اغلب عوامل بیماری زا در شرایط اسیدی دستگاه گوارش قادر به تکثیر و توسعه نیستند. لاکتوباسیلها و بیفیدو باکترها با تولید اسید لاکتیک موجب کاهش pH دستگاه گوارش می شوند. اسیدهای آلی نیز با همین مکانیسم مانع از رشد و توسعه عوامل بیماریزا میشوند. امروزه سویههای تجاری در انکوباتورهای عاری از میکروارگانیسم و استریل هچ میشوند و عرضه فوری پروبیوتیکها پس از هچ نقش بسیار مهم و تعیین کنندهای در حفظ یا بهبود جمعیت میکروبی دستگاه گوارش ایفا مینمایند(Lutful Kabir, 2009). شکل 5 نشان دهنده اهمیت پروبیوتیکها در تکامل جمعیت میکروبی روده و حفاظت و ایمنی دستگاه گوارش سویه های تجاری میباشد.
 شکل 2. نحوه استقرار میکروارگانیسمها در دستگاه گوارش پرنده و نقش پروبیوتیکها در سویههای تجاری
شکل 2. نحوه استقرار میکروارگانیسمها در دستگاه گوارش پرنده و نقش پروبیوتیکها در سویههای تجاری
واژه پریبیوتیک بوسیله گیبسون و رابرفروید (1995) معرفی شد، که شامل ترکیبات خوراکی غیر قابل هضمی است که موجب تحریک رشد از طریق ممانعت انتخابی از اتصال عوامل بیماریزا به گیرندههای سطح اپیتلیوم میشوند. استفاده توام پری بیوتیک و پروبیوتیک که Symbiotic نامیده میشود، استفاده توام از این دو منبع موجب افزایش زنده مانی پروبیوتیکها میگردد (Patterson and Burkholder, 2003). حضور توام پرو و پری بیوتیک بصورت Symbiotic که در آرتویدا لحاظ شده است میتواند علاوه بر ایجاد اثرات رقابتی و ممانعت کنندگی در نشست عوامل بیماری زا بر روی سطح اپیتلیال روده، موجب افزایش بقاء و کارایی پروبیوتیکها در دستگاه گوارش گردیده و پایداری آنها را افزایش میدهد که موجب حفظ سطح ایمنی و در نهایت تحریک رشد و بهبود راندمان تولید را به همراه خواهد داشت.
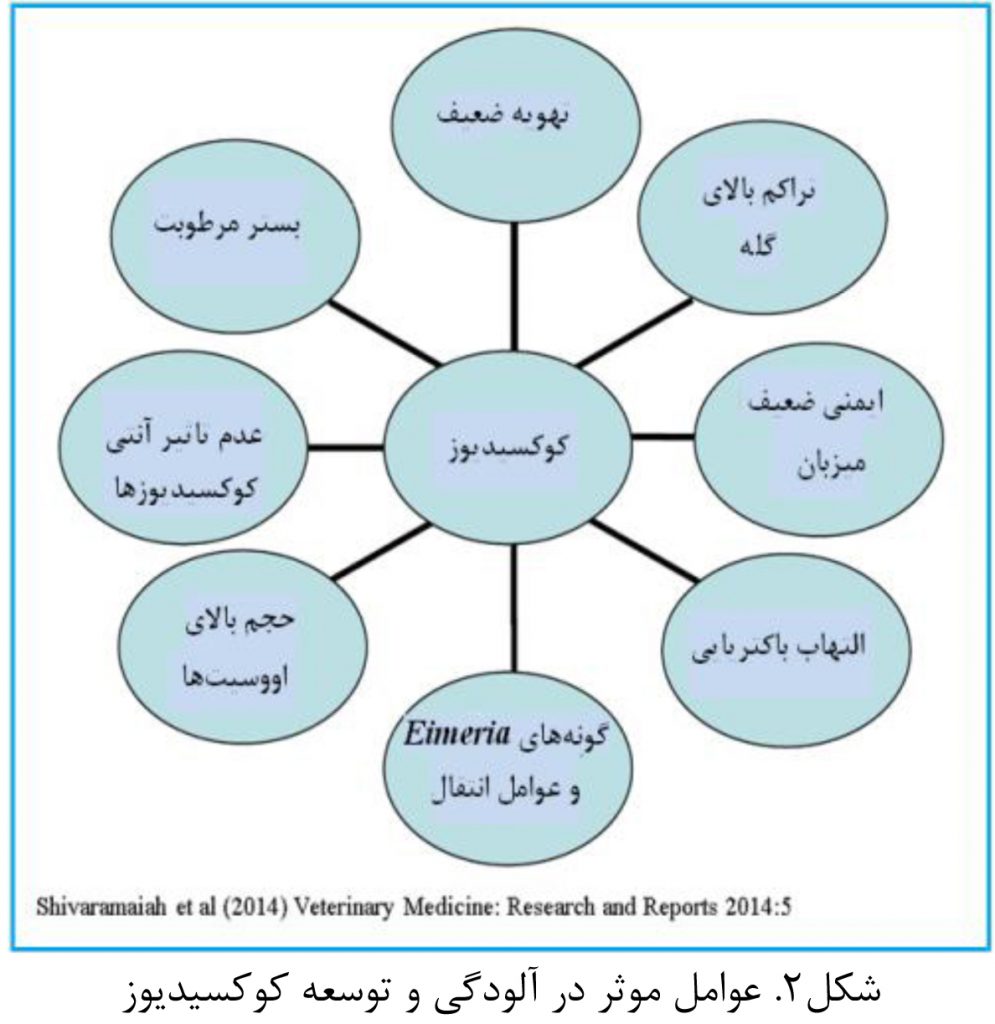
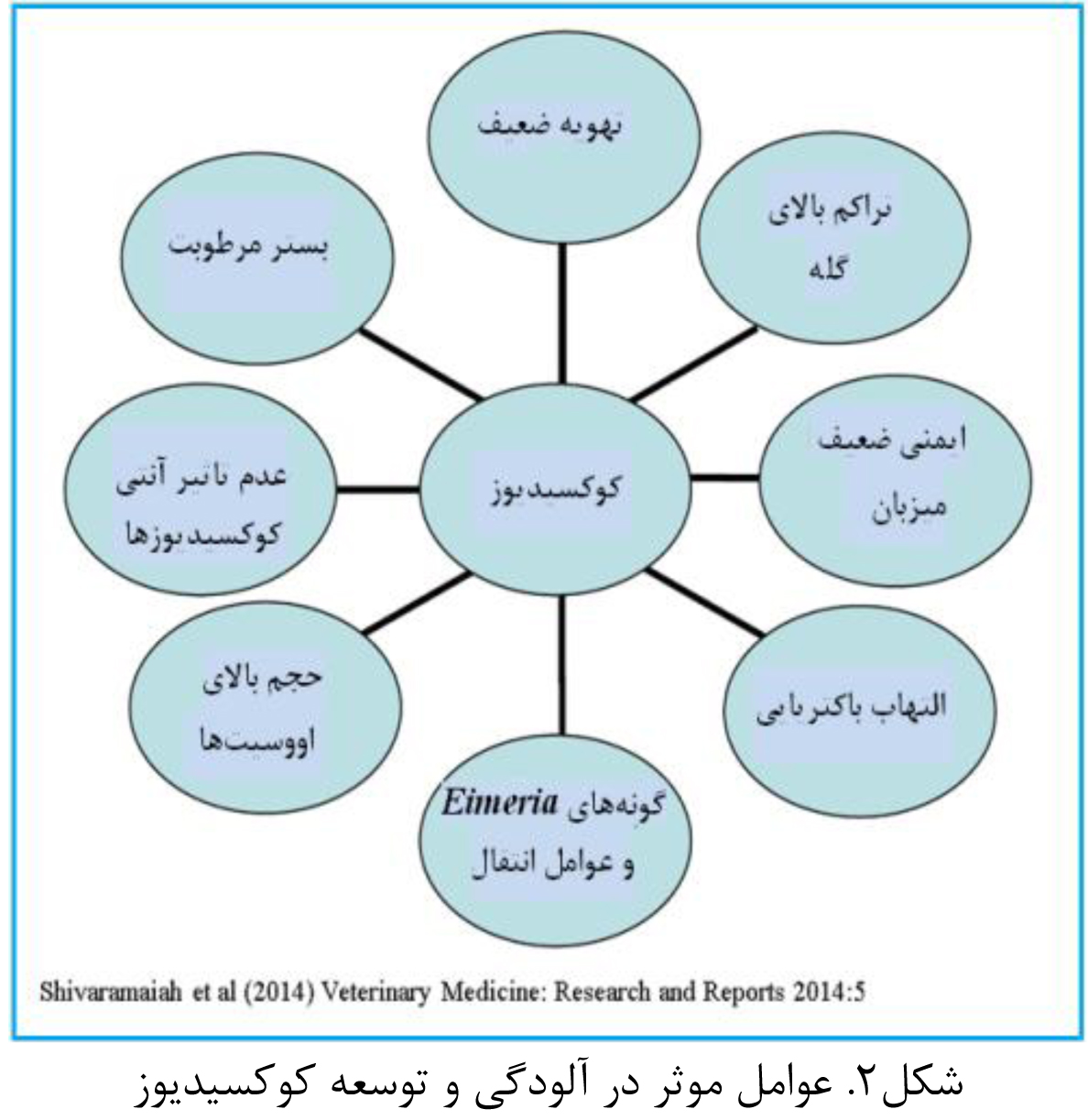
کوکسیدیوز بیماری انگلی ناشی از گونههای Eimeria است که شدت آسیب در اثر آلودگی با گونههای مختلف از این انگل متفاوت می باشد. آسیب جدی اپیتلیوم روده در اثر کوکسیدیوز اصلیترین عامل ایجاد ابتلا به باکتری کلستریدیوم پورفرینژ و تولید توکسینها توسط این باکتری و در نهایت بروز التهاب روده است. کوکسیدیوز موجب آسیب به اپیتلیوم روده و ترشح پلاسما به درون دستگاه گوارش میشود. پلاسما حاوی پروتئینهای مورد نیاز رشد، تکثیر و تولید توکسینهای باکتری کلستریدیوم میباشد و موجب توسعهی این باکتری میگردد. به همین دلیل در برخی تحقیقات برای ایجاد التهاب روده، ایمریا و کلستریدیوم در فواصل مشخص به پرنده عرضه میشود. تصویر زیر (شکل2) عوامل موثر در بروز و توسعه کوکسیدیوز را نشان میدهد (et al. 2008 Immerseel, Van).
 شکل3. عوامل موثر در آلودگی و توسعه کوکسیدیوز
شکل3. عوامل موثر در آلودگی و توسعه کوکسیدیوز
با توجه به (شکل 2) عواملی از قبیل بستر مرطوب، التهاب باکتریایی، ضعف سیستم ایمنی و… میتوانند زمینه ساز توسعه کوکسیدیوز در گله شوند. در صنعت طیور بویژه با توجه به محدودیتهای استفاده از آنتی بیوتیکها به دلیل ایجاد مقاوت باکتریایی، استراتژیهایی مبتنی بر مدیریت، پیشگیری و کنترل این عارضه با استفاده از ترکیبات آلی و تقویت کننده ایمنی، و بهره گیری از پرو و پری بیوتیکها، عصاره های گیاهی و آنزیمها در حال اجرا میباشد. پروبیوتیکها ارگانیسمهای زنده و مفید هستند که سطح سلامت و ایمنی پرنده را افزایش میدهند، در حالی که پری بیوتیک ها حاوی ترکیبات غیر قابل هضماند که با ورود به دستگاه گوارش موجب جلوگیری از توسعه میکروارگانیسمهای بیماریزا از قبیل کوکسیدیوز میشوند.
 آرتویدا و سیستم ایمنی
آرتویدا و سیستم ایمنی
واکسیناسیون بویژه واکسن گامبرو (IBD) میتواند موجب سرکوب سیستم ایمنی و فراهم شدن شرایط رشد و توسعه عوامل ایجاد کننده التهاب روده یعنی باکتری کلستریدیوم پورفرینژ گردد. معمولا در شرایط استرس ناشی از تراکم گله و توام شدن آنها با واکسیناسیون IBD میتواند مدلی برای بروز و ظهور التهاب روده باشد (et al. 2004 Mc Reynolds). مکانیسمهای اثرگذاری آرتویدا در این مرحله با توجه به فاصله زمانی زیاد مصرف آن با زمان واکسیناسیون گامبرو شامل تقویت سیستم ایمنی برای مقابله با شرایط استرس در سنین بالاتر و افزایش آنتی بادیهای انتقالی از طریق زرده و ایمنی مادری می باشد. مطالعات متعدد تایید کننده نقش بسیار مهم سیستم ایمنی در مقابله با استرس و عوامل بیماریزا در نتیجه انتقال غیر وراثتی ایمنی (دریافت آنتی بادیهای مادری ذخیره شده در زرده) از طریق مادر میباشد (Lemke et al. 2009). با توجه به مکان و موقعیت شیوع و توسعه عوامل میکروبی، حفظ سلامت سطح موکوسی دستگاه گوارش، جلوگیری از آسیبهای حاصل از محتویات دستگاه گوارش، تغذیه اسیدهای آلی و میکروارگانیسمهای مفید نقش تعیین کنندهای در کنترل بیماری خواهند داشت. آرتویدا این مسیر را از طریق بهبود سلامت دستگاه گوارش، تامین احتیاجات ویتامینی بویژه کولین که یک متیل دهنده قوی بوده و نقش مهمی در متابولیسم چربی بویژه در روزهای اولیه دارد، فراهم میکند. جذب چربی از زرده میتواند نقش تعیین کنندهای در انتقال آنتی بادیهای مادری برای مقابله با عوامل ویروسی و باکتریایی در طول دوره رشد داشته باشد.


 مقدمه
مقدمه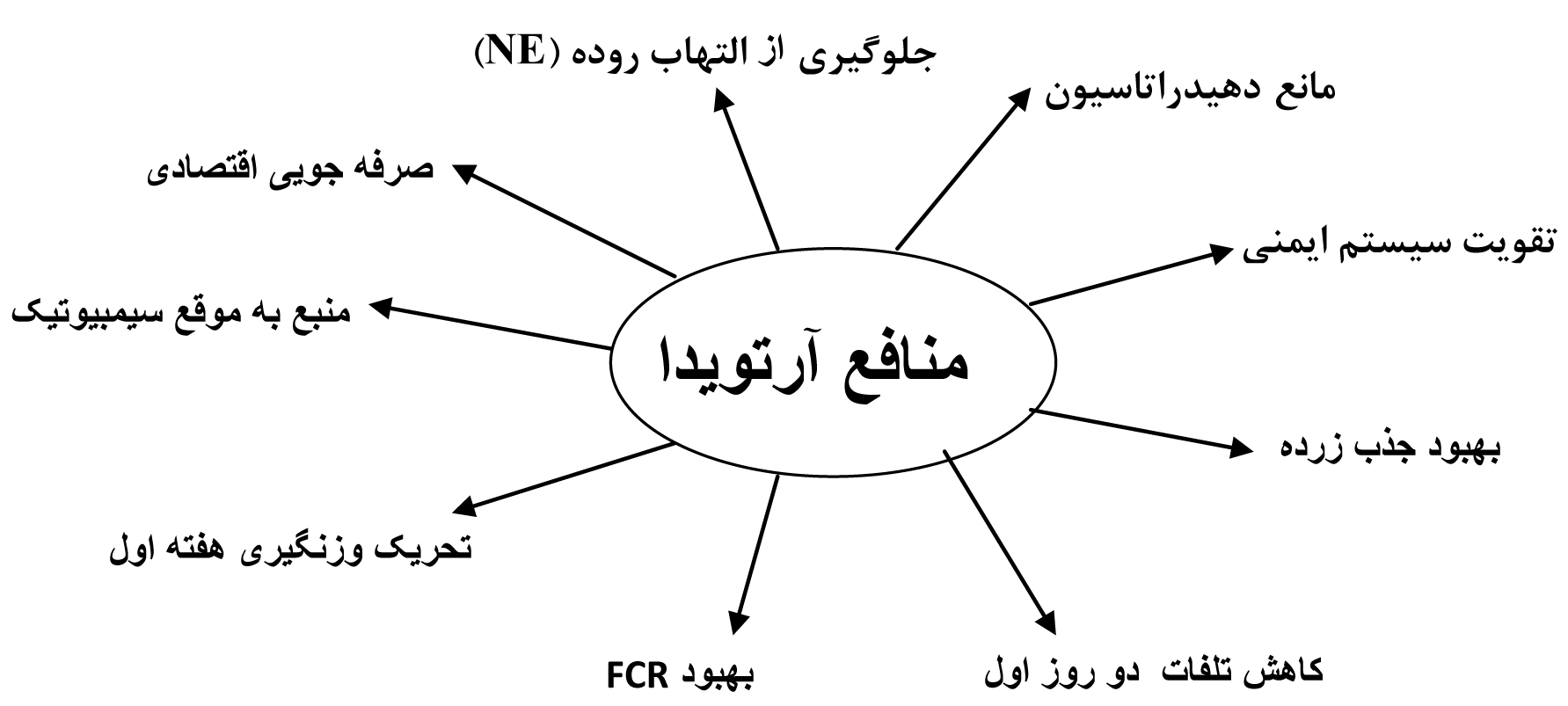
 شکل 1. مجموعه ای از عوامل اصلی و تشدید کننده
شکل 1. مجموعه ای از عوامل اصلی و تشدید کننده 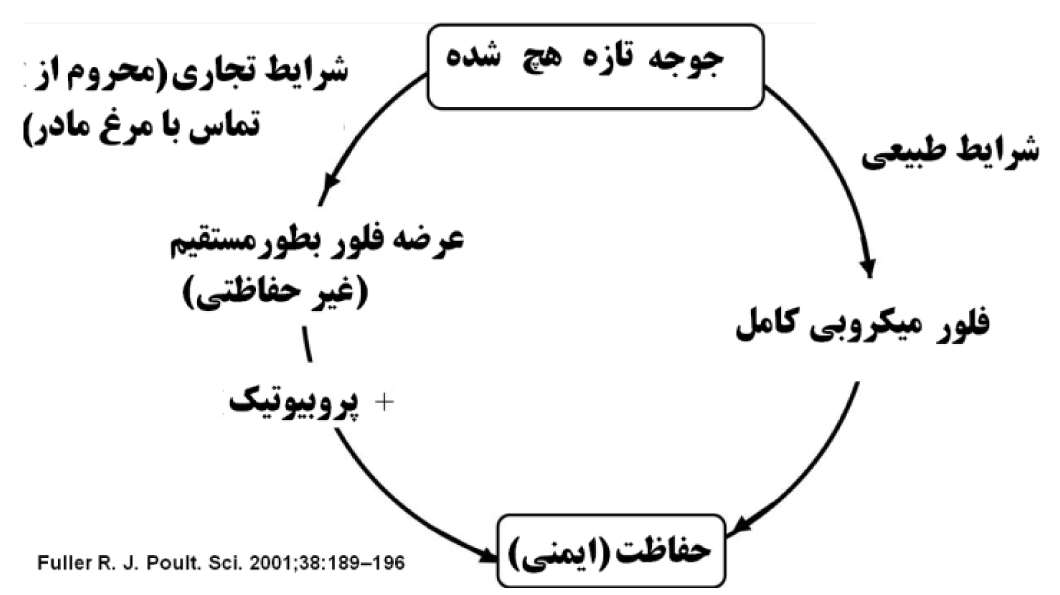
 منابع
منابع