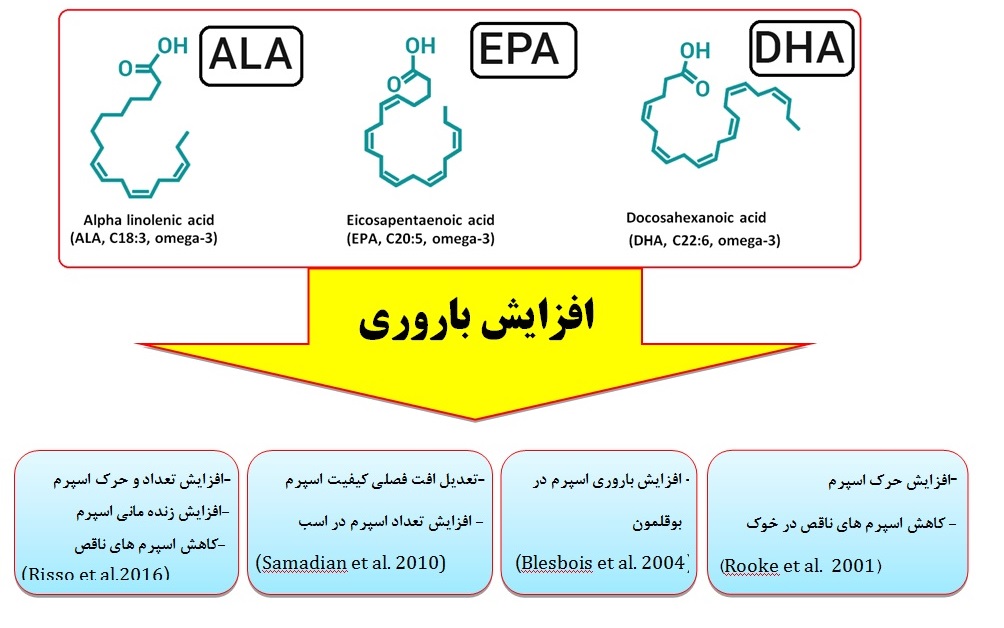
شکل1. مشتقات حاصل از اسید چرب امگا 3 و نتایج آزمایش این ترکیبات بر عوامل موثر بر باروری و برخی مطالعات انجام شده پس از سال 2000 میلادی و بر روی گونه های مختلف دام و طیور را نشان میدهد.
???????? بطور کلی نتایج تحقیقات در گونه های مختلف دام و پرندگان نر تایید کننده اثرات مشخص امگا 3 و مشتقات آن (شاملALA،EPA، DHA) بر افزایش باروری از طریق مسیرهای ذیل میباشد:
بر اساس گزارشات، تولید تخم مرغ های بارور مستلزم حضور چهار عنصر اصلی می باشد.
در این 4 عنصر حیاتی موارد اول و دوم و مرتبط با خروس مادر گوشتی، میتواند بوسیله تغذیه و جیره و نوع تغذیه تحت تاثیر قرار گیرد (Hudson, 2000).
???? مطالعات زیر نتایج مکمل سازی جیره طیور را با روغن ماهی در خروس ها تایید میکنند.
الف: از طریق تاثیر بر کیفیت اسپرم
بیش از 65 درصد از چربی بیضه ها و اسپرم را اسید های چرب بلند زنجیر غیر اشباع تشکیل میدهند ( Poulos et al 1973; Maldjian et al. 2003 )، این اسیدهای چرب اغلب شامل آراشیدونیک اسید (AA)، DHA و DPA با نسبت های متفاوت در گونه های مختلف میباشند (Bieri et al.1965). باروری اسپرم با تغییر در ساختار اسیدهای چرب فسفولیپیدی اسپرم، دچار تغییر میگردد (Blesbois et al. 2004). افزایش نسبت اسیدهای چرب غیر اشباع امگا 3 در ساختار فسفولیپیدی اسپرم موجب افزایش انعطاف پذیری و سیالیت دیواره سلولی اسپرم میگردد و این تغییرات در دیواره سلولی اسپرم موجب افزایش توان حرکتی اسپرم خواهد شد (Strzeżek et al. 2004). درمطالعاتRocha et al. (2009) ، تغذیه روزانه مخلوطی از امگا 3، امگا 6 و ویتامینE موجب افزایش حجم، غلظت و توان اسپرم در سگها گردید.
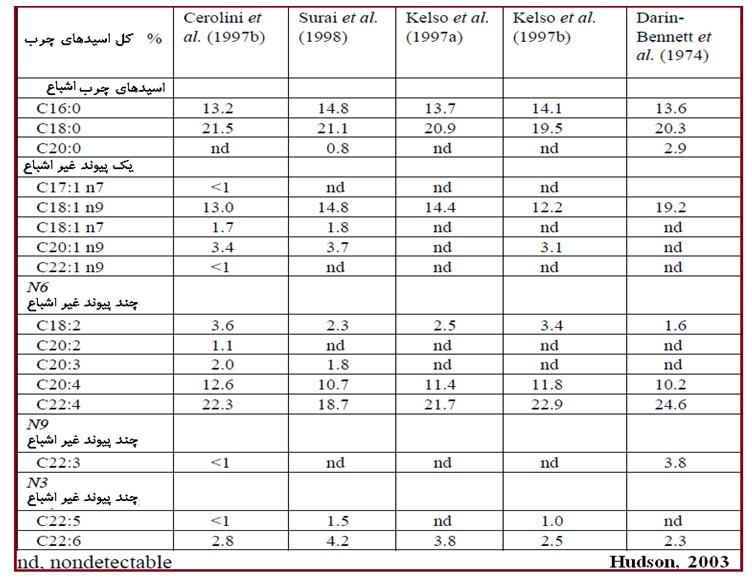
جدول1. گزراش های مختلف محققین پیش از سال 2000 میلادی درباره پروفیل و درصد اسیدهای چرب اسپرم طیور را نشان میدهند. ترکیب اسیدهای چرب دیواره اسپرم یک عامل تعیین کننده در انعطاف پذیری مورد نیاز دم اسپرم برای حرکت نرمال است. همبستگی مثبت بین درصد اسیدچرب سری امگا 3 و تحرک اسپرم وجود دارد (Cerolini et al., 1997a). پروفایل و درصد اسیدهای چرب موجود در اسپرم طیور. Cerolini et al. (1997b) همبستگی مثبتی را بین درصد اسیدهای چرب سری امگا 3 (Ω3) و میزان تحرک اسپرم ها مشاهده کرد.
الف – باروری اسپرم
اسیدهای چرب ضروری امگا 3 و امگا 6 به دلیل عدم سنتز در بدن پرندگان بایستی از طریق جیره تامین شوند. این دو اسید چرب پیش ساز ترکیبات بلند زنجیر و تقریبا ناپایدار به نام ایکوزانوئیدها هستند که به عنوان متابولیتهای حد واسط در واکنش های هورمونی، ایمنولوژیک، پاتولوژیک و … نقش ایفا می نمایند. اسید چرب امگا 6 دارای دو اتصال غیر اشباع و پیش ساز آرشیدونیک اسید (AA) است، در حالی که اسید چرب امگا 3 دارای سه اتصال غیر اشباع و پیش ساز اسیدهای بلند زنجیر سری امگا 3 شامل EPA و DHA است. درآزمایشات Gulaya et al., 2001 در نمونه های انسانی مشخص شد که افزایش تحرک اسپرم همبستگی و ارتباط مثبتی با افزایش سطح اسید های چرب بلند زنجیر مشتق شده از امگا 3 (DHA وEPA) در پلاسمای سمینال دارد، درحالی که افزایش سطح امگا 6 در پلاسمای سیمن موجب کاهش فعالیت اسپرم میگردید.
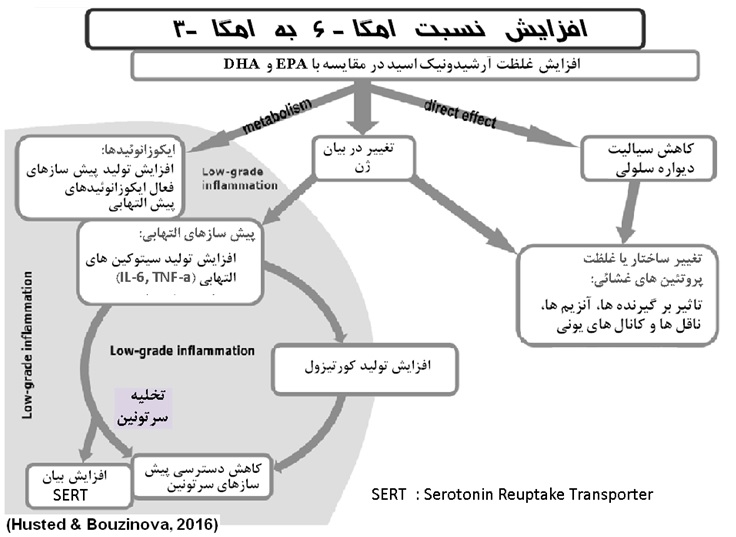
ب- متابولیسم سلولی
ترکیب اسیدهای چرب غیر اشباع دیواره سلولی عمدتا وابسته به جیره است. جیره ای با نسبت پایین امگا6 به امگا 3 بدلیل مشارکت رقابتی در دیواره فسفولیپیدی، منجر به افزایش نسبت EPA و DHA در مقایسه با ارشیدونیک اسید در غشاء سلولی خواهد شد (Galder. 2010). لینولنیک اسید (امگا3) و اسید های بلند زنجیر مشتق شده از آن، به دلیل مشارکت در ساختمان فسفولیپیدها، از اجزاء ساختاری مهم در دیواره لیپیدی و دولایه سلولی اند. حضور این اسیدهای چرب نقش بسزایی در نفوذپذیری و سیالیت دیواره سلولی ایفا میکنند. افزایش تعداد باندهای دوگانه در زنجیره کربنی موجب افزایش پیچ و تاب در ساختار سه بعدی اسید چرب را باعث میشود. افزایش پیچ و تاب در زنجیره اسید چرب موجب افزایش حجم و افزایش فضای اشغال شده بوسیله اسید چرب در دیواره سلولی و در نتیجه افزایش سیالیت غشاء خواهد شد. تغییر در ساختار و سیالیت غشاء لیپیدی سلول موجب تغییر در ساختار پروتئین های غشاء می شوند که به عنوان گیرنده، ناقل و آنزیم عمل میکنند. ثابت شده است که اسید های بلند زنجیر فعالیت آنزیم های باند کنند از قبیل Na+/K+-ATPase ، نوروترانسمیتر ها، کانال های یونی و فعالیت گیرنده ها را تحت تاثیر قرار میدهند. شکل 2. نقش افزایش اسید چرب امگا6 را در مسیر های بیوشیمیایی موثر در بروز التهابات نشان میدهد. مطالعات yung feng, et al. 2015بر روی خروس های جوان با استفاده از جیره های حاوی نسبت 1 به 4 از امگا 3 به امگا 6، حاکی از تاثیر مثبت نسبت های متعادل n-6/n-3 در بیان ژن گیرنده های هورمون های جنسی بود.
ج- سیستم ایمنی
اثرات اسیدهای چرب سری امگا 3 محدود به افزایش باروری خروس ها نمیشود و میتواند سایر پارامترهای تولیدی و سلامت عمومی پرنده را نیز تحت تاثیر خود قرار دهد. ارشیدونیک اسید (AA) محصول سنتز شده از امگا6 میتواند به عنوان یکی از پیش سازهای ترکیبات فعال در ایجاد التهاب بکار رود. در حالی که EPA وDHA کاهش متابولیت های موثر در بروز التهابات را موجب میشوند. مطالعات نشان میدهد افزودن روغن ماهی به جیره طیور که حاوی مقادیر مناسب اسیدهای بلند زنجیر امگا 3 ، EPA و DHA است میتواند موجب تقویت سیستم ایمنی از طریق تولید آنتی بادی (, 1991Fritsche et al. ) و همچنین افزایش مقاومت پرنده در مقابله با کوکسیدیوز و سالمونلا گردد (Korver and Klasing, 1997a).
د- تکامل اسپرم
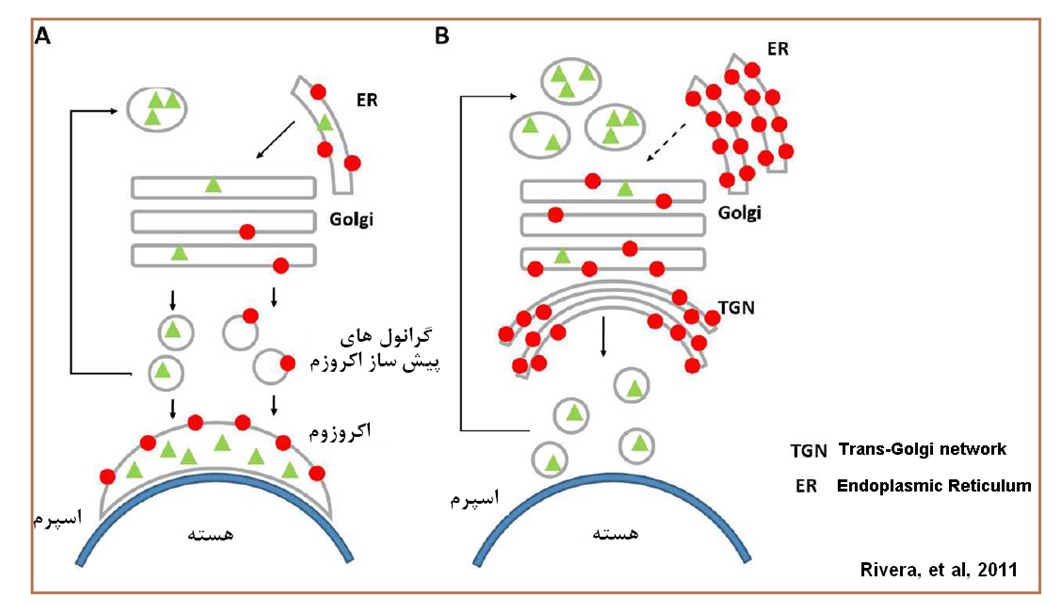
اکروزوم ناحیه ای در نوک اسپرم،کیسه مانند و حاوی آنزیم های هضمی برای نفوذ سر اسپرم به تخمک است. توسعه و تکامل این ناحیه نقش مهمی در باروری اسپرم ایفا مینماید. نتایج آزمایشات Rivera, et al, (2011) نشان داد در زمان کمبود اسید چرب بلند زنجیرغیر اشباع، علارغم حضور پیش سازهای اکروزوم یک اختلال در تکامل آکروزوم (شکل 4) رخ می دهد، که به دلیل نقص در اتصال مناسب پیش سازهای اکروزوم به هم و تشکیل کیسه اکروزوم است. در تحقیقات آنها مکمل سازی DHA این نقیصه را برطرف نمود و ایجاد اکروزوم از سر گرفته شد در حالی که آرششیدونیک اسید بدون تاثیر بود.
شکل4.A . تشکیل آکروزوم درشرایط طبیعی شامل انتقال مناسب پیش سازهای اکروزوم از شبکه اندوپلاسمی و دستگاه گلژی و اتصال آنها و تشکیل اکروزوم بر روی سر اسپرم.
B . اختلال در انتقال و اتصال پیش سازهای اکروزوم در شرایط کمبود اسید های چرب بلند زنجیر غیر اشباع و در نهایت تجمع پیش سازهای اکروزوم در شبکه انتقالی گلژی ( TGN).
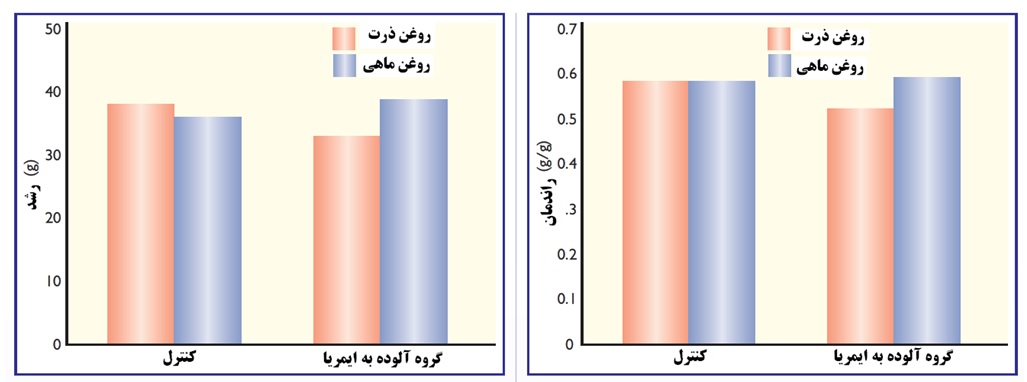
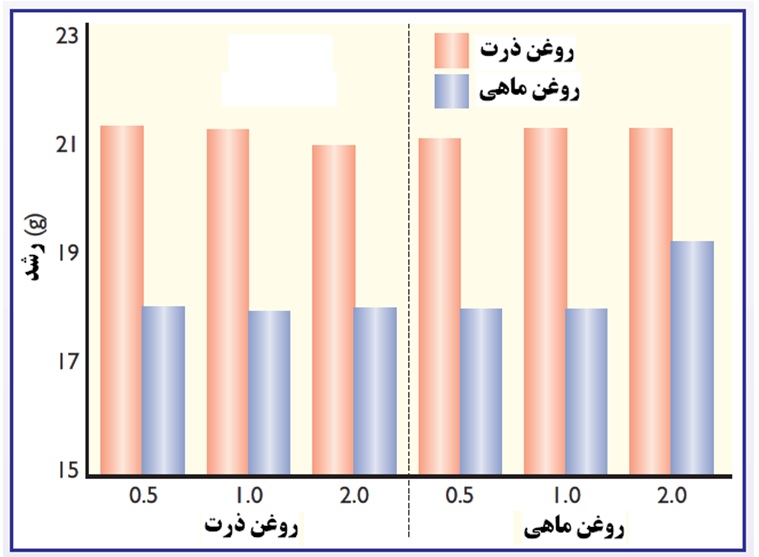
شکل 3. مقایسه تغذیه روغن ماهی و روغن ذرت در زمان آلودگی به کوکسیدیوز در جوجه های گوشتی. روغن ماهی موجب افزایش رشد و بهبود راندمان در زمان آلودگی گله به کوکسیدیوز گردید
(Korver and Klasing, 1997a)
شکل 4. مقایسه عملکرد طیور با تغذیه روغن ماهی و روغن ذرت در زمان آلودگی با لیپوپلی ساکاریدهای سالمونلا.
در مجموعه مکانیسم های موثر در باروری بویژه اثرات اسیدهای چرب بلند زنجیر بایستی برهمکنش اسیدهای چرب با آنتی اکسیدان ها بویژه آنتی اکسیدانهای محلول در چربی شامل ویتامین E مورد توجه قرار گیرند. موارد زیر برخی برهمکنش های بین اسید های بلند زنجیر و ویتامین E می باشد که توجه به این موارد میتواند منجر به حصول نتایج مورد انتظار در زمان استفاده از اسیدهای چرب امگا 3 گردد.
- ویتامین E بطور مشخص موجب کاهش پراکسیداسیون اسیدهای چرب بلند زنجیر مایع سیمن و اسپرم میشود.
- افزودن اسیدهای چرب به جیره طیور موجب تغییر در احتیاجات ویتامینE بویژه احتیاجات ویتامین E در باروری خواهد شد
- ویتامین E همانند اسیدهای چرب پس از کبد بطور گسترده در سراسر بدن و در دیواره فسفولیپیدی دولایه سلولها ذخیره میشود ( Deivendran, and Yeong, 2015).
- ویتامین E در جذب لیپیدها از روده میتواند موثر باشد (Green, 1972).
- ویتامین E در تولید استروئیدها و متابولیسم دخالت دارد (Nair, 1972).
- ویتامین E درسنتز استروئیدها مشارکت میکند که از این طریق در باروری و همچنین سیستم ایمنی (سلولی و همورال) نقش ایفا مینماید (Tengerdy, 1989).
ویتامینE درمجموعه ای از واکنش ها و فعالیت های حیاتی در ارتباط با اسیدهای چرب، ویتامین ها، آنتی اکسیدان ها، نقل و انتقالات آمینو اسیدها، و مواد معدنی نقش ایفا مینماید. ویتامینE جیره بعد از ورود به دستگاه گوارش و جذب از آن به دلیل حلالیت در چربی عمدتا در کبد، چربی ذخیره ای بافتها و در دیواره غشاء فسفولیپیدی سلولها در سرتاسر بدن ذخیره میشود و بنابراین این ویتامین که به عنوان یک آنتی اکسیدان قوی و موثر و محلول در چربی شناخته شده علاوه بر موارد فوق، از دیواره سلولی در برابر رادیکالهای آزاد و انواع اشکال اکسیژن فعال که در زمان استفاده از اسیدهای چرب غیر اشباع سر شار از پیوندهای دوگانه است محافظت میکند. یکی از نقش های حیاتی این ویتامین دخالت درسنتز استروئیدها و متابولیسم آهن میباشد که از این طریق در باروری و همچنین سیستم ایمنی (سلولی و همورال) نقش ایفا مینماید (Tengerdy, 1989). شکل زیر نقش ویتامین E را در باروری گونه های مختلف طیور نشان میدهد.
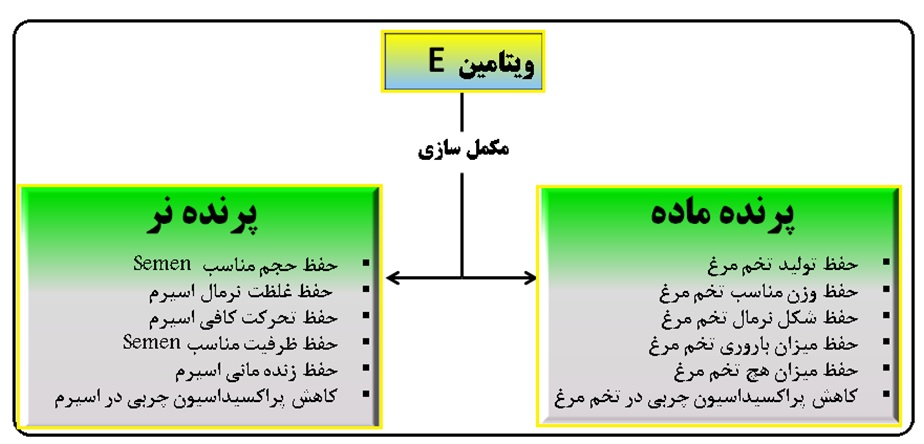
شکل 5. اثرات ویتامین E جیره بر باروری گونه های مختلف طیور(Deivendran and Yeong Ho, 2015)
در حال حاضر منابع متنوعی از مکمل های تجاری حاوی امگا3 با منشاء دریایی و گیاهی وجود دارد. علی رغم اهمیت بالای اسید چرب امگا3 ، مطالعات نشان میدهد که در بدن تبدیل و بیوسنتز اسیدهای چرب امگا3 به EPA و DHA که نقش های حیاتی در متابولیسم سلولی، باروری و سیستم ایمنی ایفا مینمایند (عمدتا به دلیل حضور رقابتی اسید چرب امگا6 ) ناچیز است. تبدیل آلفا لینولنیک به EPA بشدت محدود و تبدیل آلفا لینولنیک به DHA و همچنین تبدیل EPA به DHA تقریبا قابل اغماض است (Brenna et al. 2009). این یافته ها ضرورت انتخاب محصولات حاوی مقادیر مناسبی از DHA و EPA (که عمدتا در منابع دریایی بویژه روغن سالمون یافت میشود) را کسب نتایج مورد انتظار آشکار میسازد. شکل زیر مسیر بیوسنتز مشتقات امگا3 را در سطح میکروزوم و پراکسیزوم و نقش جیره در تامین این مشتقات را نشان میدهد.
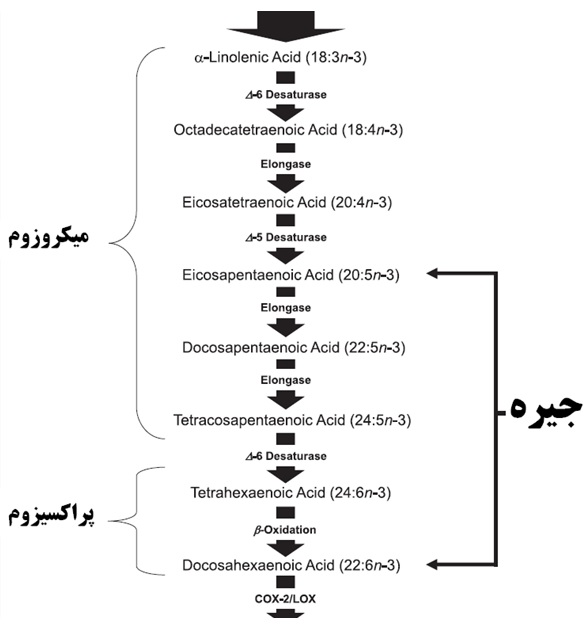
شکل6. مسیر متابولیسم DHA از امگا 3 و اهمیت تامین این متابولیت ها را از طریق جیره را نشان میدهد.
برخلاف اثرات مثبت گزارش شده در استفاده از روغن ماهی در باروری سلامت و ایمنی پرندگان نر، کاربرد روغن ماهی با وجود تاثیرات مثبت بر پروفایل اسیدهای چرب زرده و نقش بسزای آن در ارتقاء سلامت مصرف کننده در طیور مادر تخم گذار، استفاده از روغن ماهی در مرغ های مادر به دلایل متعدد از قبل تغییر متابولیسم چربی در کبد و کاهش چربی سرم و انتقال چربی به تخمدان و در نهایت کاهش وزن و اندازه تخم مرغ، کاهش باروری، افزایش شکستگی و … توصیه نشده است.
منابع :
Alarcon, L. M., Chavarro, J. E ., Mendiola, J., Roca, M., Tanrikut, C., Vioque, J., Jorgensen N., Torres‑Cantero, A. M . (2017) Fatty acid intake in relation to reproductive hormones and testicular volume among young healthy men .Asian Journal of Andrology 19:184–190
Bieri JG, Prival EL. Lipid composition of testes from various species. Comp Biochem Physiol 1965;15: 275– 82.
Blesbois E, Douard V, Germain M, Boniface P, Pellet F. Effects of n-3 polyunsaturated dietary supplementation on the reproductive capacity of male turkeys. Theriogenology. 2004; 61(2-3): 537-549.
Blesbois, E., M. Lessire, I. Grasseau, J.M. Hallouis, and D. Hermier, 1997. Effect of dietary fat on the fatty acid composition and fertilizing ability of fowl semen. Bio. Repro. 56:1216-1220.
Brenna JT, Salem Jr N, Sinclair AJ, Cunnane SC. 2009. International society for the study of fatty acids and lipids, ISSFAL. alpha-Linolenic acid supplementation and conversion to n-3 long-chain polyunsaturated fatty acids in humans. Prostagl. Leukot. Essent. Fat. Acids 80:85e91.
Calder, P. C. (2010) Omega-3 fatty acids and inflammatory processes. Nutrients, 2(3):355–74.
Casanovas, P., 1999. Methods of alleviating the age-related decline in fertility of broiler breeder males. Thesis (M.S.): University of Georgia, Athens, GA.
Castellano CA, Audet I, Laforest JP, Matte JJ, Suh M. (2011) Fish oil diets alter the phospholipid balance, fatty acid composition, and steroid hormone concentrations in testes of adult pigs. Theriogenology.; 76(6): 1134-1145.
Cerolini, S., K.A. Kelso, R.C. Noble, B.K. Speake, F. Pizzi, and L.G. Cavalchini, 1997a. Relationship between spermatozoan lipid composition and fertility during aging of chickens. Bio. Repro. 57:976-980.
Cerolini, S., P. Surai, A. Maldjian, T. Gliozzi, and R. Noble, 1997b. Lipid composition of semen in different fowl breeders. Poultry Avian Biol. Rev. 8:141-148.
Chanmugam P, Boudreau M, Boutte T, Park RS, Hebert J, Berrio L, Hwang DH. Incorporation of different types of n-3 fatty acids into tissue lipids of poultry. Poultry Science 1992; 71:516-521.
Deivendran, R and H, Yeong Ho. (2015) Effects of Dietary Vitamin E on Fertility Functions in Poultry Species. Int. J. Mol. Sci., 16; 9910-9920
Fedna. Normas FEDNA para la formulación de piensos compuestos. Madrid: Ediciones Peninsular; 1999
Green, J. Vitamin E and the biological antioxidant theory. Ann. N. Y. Acad. Sci. 1972, 203, 29–44.
Gulaya NM, Margitich VM, Govseeva NM, Klimashevsky VM, Gorpynchenko II, Boyko MI. 2001. Phospholipid composition of human sperm and seminal plasma in relation to sperm fertility. Archives of Andrology, 46:169–175
Hudson, B. P, (2000) Alternative sources of fat and zinc in broiler breeder diets and their influences on performance, Thesis (Ph.D): University of Georgia, Athens
Hudson, B. P. and J. L. Wilson. (2003) Effects of Dietary Menhaden Oil on Fertility and Sperm Quality of Broiler Breeder Males. J. Appl. Poult. Res. 12:341–347
Husted, K. S and E. V. Bouzinova (2016).The importance of n-6/n-3 fatty acids ratio in the major depressive disorder. Review, m e d i c i n a, 52:139 – 147
Kelso, K.A., S. Cerolini, B.K. Speake, L.G. Cavalchini, and R.C. Noble, 1997b. Effects of dietary supplementation with α-linolenic acid on the phospholipid fatty acid composition and quality of spermatozoa in cockerel from 24 to 72 weeks of age. J. Repro. Fert. 110:53-59.
Kelso, K.A., S. Cerolini, R.C. Noble, N.H. Sparks, and B.K. Speake, 1997a. The effects of dietary supplementation with docosahexaenoic acid on the phospholipid fatty acid composition of avian spermatozoa. Comp. Biochem. Phys. 118(1):65-69.
Maldjian A, Penny PC, Noble RC. Docohexaenoic acid-rich marine oils and improved reproductive efficiency in pigs. In: A.B. DVSRC (ed), Male Fertility and Lipid Metabolism. Champaign (Illinois, USA): AOCS Press, 2003; 60 –72
Nair, P.P. Vitamin E and metabolic regulation. Ann. N. Y. Acad. Sci. 1972, 203, 53–61
Newman, RE, Bryden, WL, Fleck, E, ASHES, JR, Buttemer, WA, Storlien, LH, Downing, JA. Dietary n-3 and n-6 fatty acids alter avian metabolism: molecular-species composition of breast-muscle phospholipids. British Journal of Nutrition 2002; 88:11-18.
Phetteplace HW, Watkins A. Lipid measurements in chickens fed different combinations of chicken fat and Menhaden oil. Journal Agricultural of Food Chemistry 1990; 38:1848-1853.
Poulos A, Darin-Bennett A, White IG. The phospholipid-bound fatty acids and aldehydes of mammalian spermatozoa. Comp Biochem Physiol B 1973;46:541–9.
Risso A, Pellegrino FJ, Relling AE, et al. (2016) Effect of long-term fish oil supplementation on semen quality and serum testosterone concentrations in male dogs. Int J Fertil Steril 10, 223–231
Rivera, M. R., Timothy L. A., M. S., R. A. H. and Nakamura, M. T. (2011). Deficiency in the Omega-3 Fatty Acid Pathway Results in Failure of Acrosome Biogenesis in Mice, BIOLOGY OF REPRODUCTION 85: 721–732
Robert K. McNamara (2016) Role of Omega-3 fatty acids in the etiology, treatment, and prevention of depression: Current status and future directions. Journal of Nutrition & Intermediary Metabolism, 5: 96-106
Rooke JA, Shao CC, Speake BK. Effects of feeding tuna oil on the lipid composition of pig spermatozoa and in vitro characteristics of semen. Reproduction. 2001; 121(2): 315-322.
Samadian F, Towhidi A, Rezayazdi K, Bahreini M. Effects of dietary n-3 fatty acids on characteristics and lipid composition of ovine sperm. Animal .2010; 4(12): 2017-2022.
Scaife JR, Moyo J, Galbraith H, Michie W, Campbell V. Effect of different dietary supplemental fats and oils on the tissue fatty acid composition and growth of female broilers. British Poultry Science 1994; 35:107-118.
Sebokova E, Garg ML, Wierzbicki A, Thomson ABR, Clandinin MT. Alteration of the lipid composition of rat testicular plasma membranes by dietary (n-3) fatty acids changes the responsiveness of Leydig cells and testosterone synthesis. J Nutr 1990;120: 610–8.
Strzeżek J, Fraser L, Kuklińska M, Dziekońska A, Lecewicz M. Effects of dietary supplementation with polyunsaturated fatty acids and antioxidants on biochemical characteristics of boar semen. Reprod Biol. 2004; 4(3): 271-287.
Surai, P.F, S. Cerolini, G.J. Wishart, B.K. Speake, R.C. Noble, and N.H. Sparks, 1998. Lipid and antioxidant composition of chicken semen and its susceptibility to peroxidation. Poult. Avian Biol. Rev. 9:11-23.
Tengerdy, R.P. Vitamin E, immune response, and disease resistance. Ann. N. Y. Acad. Sci. 1989,570, 335–344.
Yun Feng., Yu Ding., Juan Liu., Ye Tian., Yanzhou Yang., Shuluan Guan., and Cheng Zhang.2015.Effects of dietary omega-3/omega-6 fatty acid ratios on reproduction in the young breeder rooster. BMC Veterinary Research, 11:73